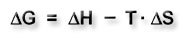Antwort C
zurück zur Frage |
 |
Durch die Gibbs-Helmholtz-Gleichung wird der Zusammenhang zwischen der Änderung der freien Enthalpie ΔG, der Reaktionsenthalpie ΔH und dem Entropieglied TΔS dargestellt.
|
|
(Klicken Sie in die Formel für eine tabellarische Zusammenfassung
|
Sie gilt für isotherme und isobare Vorgänge.
ΔG beschreibt, ob eine Reaktion exergon ist, d.h. freiwillig abläuft (ΔG < 0).
Reaktionen mit Werten für ΔG > 0 bezeichnet man als endergon.
ΔH ist ein Maß für die Wärmeentwicklung der Reaktion.
Wird Wärme abgegeben, spricht man von exothermen Reaktionen (ΔH < 0).
Exotherme Reaktionen sind stets exergon (das Glied TΔS kann nicht negativ werden).
Endothermen Reaktionen können aber exergon werden, wenn der Wert für TΔS > ΔH ist, d.h. wenn die Temperatur und die Entropieänderung einen genügend großen Gesamtbetrag in die Bilanz der Reaktion einbringen.
Katalysatoren beeinflussen die Aktivierungsenergie einer Reaktion.
Sie haben keinerlei Einfluss auf die freie Enthalpie ΔG.