"Klassische" Kupferzentren in Proteinen
Kupfer spielt bei zahlreichen biologischen Prozessen, die mit Elektronenübertragungsreaktionen verbunden sind, eine Rolle. Seine Funktionen reichen vom einfachen Elektronentransfer über die Sauerstoffaktivierung bis hin zum Sauerstofftransport.
Damit haben die Kupferproteine häufig gleiche Funktionen, wie sie auch von Eisenzentren übernommen werden. Das ist ein weiterer Beleg dafür, dass die natürliche Evolution "erfolgsorientiert" und nicht "strukturorientiert" ablief. Ein instruktives Beispiel dafür ist das Enzym Nitritreduktase, dessen reaktives Zentrum sowohl ein Häm-Eisen-Komplex als auch ein Kupferkomplex vom Typ 1 sein kann.
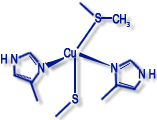
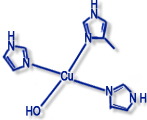
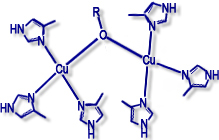
Kupferproteine werden häufig nach Typen unterschieden, die sich von der Struktur der Umgebung des Metall-Ions bzw. spektroskopischen Eigenschaften des Zentrums (EPR-Signal, Farbe etc. ableiten).
Typ I ("Blaue" Kupferproteine) |
Typ II ("Nichtblaue" Kupferproteine) |
Typ III (Dimere) |
|
|
|
|
|
|
|
| Beispiele: Plastocyanin, Azurin, Nitrit- Reduktase |
Beispiele: Galactose-Oxidase, Amin-Oxidasen, Dopamin- Monooxygenase |
Beispiele: Hämocyanin, Tyrosinase |