Säuren und Basen
Als Säuren und Basen bezeichnet man nach Bronsted Stoffe, die in dazu in der Lage sind, Wasserstoffionen abzugeben (Protonendonatoren, Säuren) oder aufzunehmen (Protonenakzeptoren, Basen). Als Säure-Base-Reaktionen bezeichnet man solche, bei denen Protonen übertragen werden. Neben dem gängigen Bronsted-Konzept gibt es andere Säure-Base-Konzepte wie die Beschreibung nach Arrhenius oder die nach Lewis. Bei letzterem Konzept werden Säuren als elektrophile Elektronenpaar-Akzeptoren und Basen als Elektronenpaar-Donatoren beschrieben.
Über den negativen dekadischen Logarithmus der Wasserstoffionenkonzentration (den pH-Wert) ist ein quantitatives Maß für die Bewertung von Stoffen hinsichtlich ihres Säure- oder Basencharakters gegeben. Stoffe mit einem pH-Wert kleiner als 7 sind Säuren, Stoffe mit einem pH-Wert größer als 7 sind Basen.
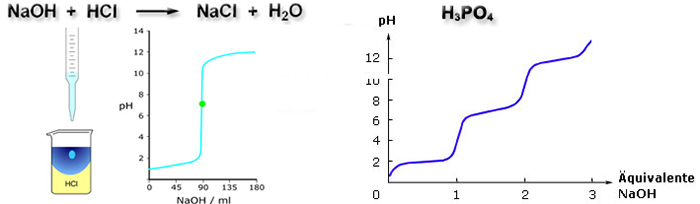
Dieser Fragenkomplex beschäftigt sich mit der Zuordnung von Säuren und Basen, der Berechnung von pH-Werten und Abschätzungen zur Säure-Base-Titration.
