Antwort A
zurück zur Frage |
 |
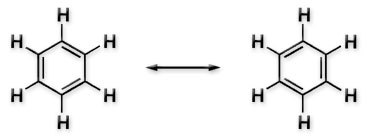
Alle C-Atome im Benzen sind sp2-hybridisiert.
Die drei Doppelbindungen sind zyklisch konjugiert, also aromatisch.
Für die optimale Überlappung der p-Orbitale müssen alle C-Atome in einer Ebene (der σ-Bindungsebene) liegen.
Aus den Bindungswinkeln von 120° (sp2-Hybridisierung) ergibt sich, dass auch die H-Atome in der σ-Bindungsebene liegen.
Benzen
(Für eine 3D-Darstellung ins Bild klicken)