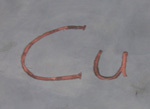Frage 5 - Antwort E
zurück zur Frage |
 |
Die Redoxgleichung 
beschreibt die Oxidation von Zn zu Zn2+ durch die Reaktion von Cu2+ zu Cu.
Bei beiden Metallen gehen zwei Elektronen über (vom Zn zum Cu), das heißt, die Oxidationszahlen beider Metalle ändern sich jeweils um den Wert 2.
Für die Faktoren der Reaktionsgleichung bedeutes das, dass sowohl x, als auch y, z und t den Wert 1 annehmen: