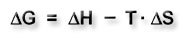Frage 9 - Antwort D
zurück zur Frage |
 |
Durch die Gibbs-Helmholtz-Gleichung wird der Zusammenhang zwischen der Änderung der freien Enthalpie ΔG, der Reaktionsenthalpie ΔH und dem Entropieglied TΔS dargestellt.
|
|
ΔG = Änderung der freien Enthalpie ΔH = Reaktionsenthalpie ΔS = Entropieänderung T = Temperatur |
Sie gilt für isotherme und isobare Vorgänge.
Reaktionen, bei denen ΔG < 0 ist, bezeichnet man als exergon.
Sie können spontan ablaufen (wenn dem keine hohen Aktivierungsenergiebarrieren entgegenstehen).
Bei endergonen Reaktionen ist ΔG > 0.