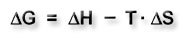Frage 9 - Antwort B
zurück zur Frage |
 |
Durch die Gibbs-Helmholtz-Gleichung wird der Zusammenhang zwischen der Änderung der freien Enthalpie ΔG, der Reaktionsenthalpie ΔH und dem Entropieglied TΔS dargestellt.
|
|
ΔG = Änderung der freien Enthalpie ΔH = Reaktionsenthalpie ΔS = Entropieänderung T = Temperatur |
Sie gilt für isotherme und isobare Vorgänge.
Die Entropieänderung ΔS beschreibt die Zu- oder Abnahme von Ordnungszuständen im betrachteten System (Entropie = Maß für die Unordnung).
ΔG beschreibt, ob eine Reaktion exergon ist, d.h. freiwillig abläuft (ΔG < 0).
Das kann auch bei endothermen Reaktionen der Fall sein, wenn der Wert für TΔS > ΔH ist, d.h. wenn die Temperatur und die Entropieänderung einen genügend großen Gesamtbetrag in die Bilanz der Reaktion einbringen.