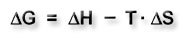Frage 1 - Antwort A
zurück zur Frage |
 |

Arrhenius-Gleichung |
Die Arrhenius-Gleichung ist ein Ausdruck aus der chemischen Kinetik. Sie stellt den Zusammenhang zwischen der Aktivierungsenergie und der Reaktions‑ Durch sie lässt sich die Aktivierungsenergie bestimmen, nicht aber ΔG. Die Änderung der freien Enthalpie ΔG berechnet sich nach der Gibbs-Helmholtz Gleichung: |
|
|
ΔG = Änderung der freien Enthalpie ΔH = Reaktionsenthalpie ΔS = Entropieänderung T = Temperatur |