Frage 4 - Antwort E
zurück zur Frage |
 |
Das Löslichkeitsprodukt von Bariumsulfat ist definiert als: 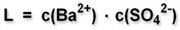
10-10 mol2/l2 = c (Ba2+) · c (SO42-) c (Ba2+) = c (SO42-)
10-10 mol2/l2 = c 2(Ba2+)
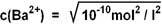
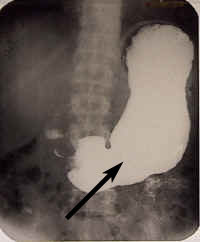
Röntgenbild eines Magens
|
Ein Mol BaSO4 wiegt 233 g (Ba: 137 g/mol, S: 32 g/mol, O: 16 g/mol). 233 g · 10-5 = 2,33 g · 10-3 = 2,33 mg Diese ausgesprochen geringe Löslichkeit erlaubt es, Bariumsulfat als Kontrastmittel bei Röntgenuntersuchungen zu verwenden. Das besser lösliche Bariumchlorid dagegen ist sehr toxisch. |
