Frage 5 - Antwort A
zurück zur Frage |
 |
Der Äquivalenzpunkt einer Titration ist der Wendepunkt der Kurve, an dem äquivalente Mengen von Säure und Base miteinander reagiert haben.
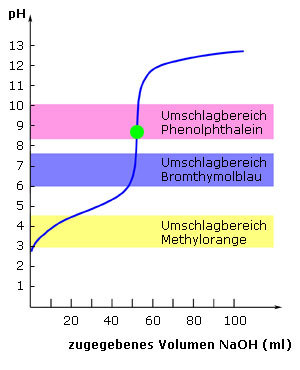
Titration einer schwachen Säure mit einer
|
Die Lage des Äquivalenzpunktes auf der pH-Skala ist von der Natur der reagierenden Stoffe abhängig: Bei Titration einer (a) starken Säure mit einer starken Base nahe pH 7 (b) starken Base mit einer starken Säure nahe pH 7 (c) schwachen Säure mit einer starken Base pH > 7 (d) starken Säure mit einer schwachen Base pH < 7 Grund dafür ist die Ausbildung eines Puffergemisches aus der schwachen Säure und ihren Salz mit der starken Base |
