Frage 12 - Antwort D
zurück zur Frage |
 |
Ein ideales Gas definiert einen Zustand, in dem die Atome oder Moleküle kein Eigenvolumen besitzen und keinerlei Wechselwirkungen untereinander zeigen.
Dann gilt die ideale Gasgleichung: 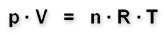
In der Realität gibt es kein ideales Gas.
Die Partikel realer Gase (Atome bei Edelgasen oder Moleküle) besitzen ein Eigenvolumen.
Reale Gase lassen sich bei niedrigen Temperaturen oder hohen Drücken verflüssigen.
Trotzdem lässt sich die ideale Gasgleichung näherungsweise auf reale Gase anwenden.
Ideales Gas (T = konstant, p = 0,1 at)
(Klicken Sie ins Manometer, um den Druck zu verändern.)
Diese Annäherung wird bei hohen Temperaturen (höhere Eigenbewegung) und kleinen Drücken (größere Abstände des Gasmoleküle oder -atome) genauer als unter Normalbedingungen.
Ein atomarer (Edelgase) oder molekularer Charakter (N2, O2, CO2 etc.) von Gasen hat keinen Einfluss auf die Geltung des idealen Gasgesetzes.
