Frage 8 - Antwort E
zurück zur Frage |
 |
Ein Verteilungskoeffizient im System Gas/Flüssigkeit berechnet sich nach dem Henry-Daltonschen Gesetz:

Kohlendioxid, CO2, reagiert in Wasser teilweise zu Kohlensäure, H2CO3, die wiederum mit Bicarbonat, HCO3-, im Gleichgewicht steht.
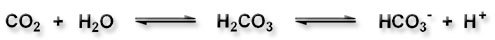
Durch diese Gleichgewichtsreaktion wird ein Teil des physikalisch gelösten Kohlendioxids verbraucht.
Damit beeinflusst die Konzentration von H2CO3, die z.B. vom pH-Wert abhängig ist, die Konzentration des Gases in der Flüssigkeit.
Nimmt die Acidität der Lösung ab, wird das H2CO3/HCO3--Gleichgewicht in Richtung der undissoziierten Kohlensäure (und damit von CO2) verschoben, und die Gesamtkonzentration des Gases in der Lösung nimmt ab.
Eine Erhöhung des Partialdruckes des Gases führt demnach zu einer Zunahme der Löslichkeit des Gases, wenn der Partialdruck des CO2 erhöht wird.
Nach dem Gasgesetz (p · V = n · R · T) ist die Konzentration des Gases temperaturabhängig
