Frage 6 - Antwort D
zurück zur Frage |
 |
pH = 1 pH = 10 |
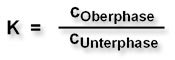
Der Verteilungskoeffizient K gibt das Verhältnis der Konzentrationen eines Stoffs zwischen zwei Phasen wieder.
Eine organische Säure unterliegt in wässriger Lösung einem Protonierungs-/Deprotonierungsgleichgewicht.
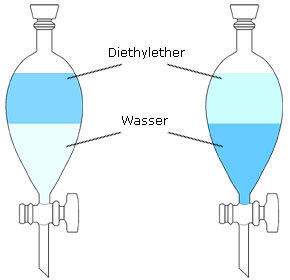
Bei pH = 1 ist die Konzentration der Wasserstoff-Ionen groß, das Gleichgewicht liegt sehr stark auf der Seite der protonierten (unpolaren) organischen Säure R-COOH, die sich aus diesem Grund stark in der unpolaren Oberphase (Diethylether) anreichert. Bei pH = 10, also in einem alkalischen Milieu, liegt das Gleichgewicht stark auf der Seite der stark polaren Carboxylat-Ionen (R-COO-), die sich deshalb bevorzugt im polaren Lösungsmittel Wasser (Unterphase) befinden. Der Verteilungskoeffizient einer organischen Säure im System Diethylether/Wasser ist daher stark vom pH-Wert abhängig. |