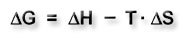Frage 4 - Antwort D
zurück zur Frage |
 |
Wird bei einer Reaktion Wärme frei, so wird sie als exotherm bezeichnet.
Die Reaktionsenthalpie ΔH nimmt also ab.
Eine Reaktion, bei der Wärme von außen in das System aufgenommen wird, wird als endotherm bezeichnet.
Anhand der Gibbs-Helmholtz-Gleichung erkennt man, dass endotherm nicht gleich endergon bzw. exotherm nicht gleichbedeutend mit exergon ist.
|
|
ΔG = Änderung der freien Enthalpie ΔH = Reaktionsenthalpie ΔS = Entropieänderung T = Temperatur |
Wird bei einer Reaktion Energie (exotherm) frei, so ist dies nicht gleichbedeutend damit, dass diese Reaktion auch spontan verläuft.
Durch den Entropieanteil ΔS ändert sich der Wert von ΔG temperaturabhängig.
Eine exotherme Reaktion läuft bei einem ΔG>0 dann nicht exergon ab.
Dasselbe gilt sinngemäß für endotherme Reaktionen.