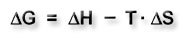Frage 4 - Antwort A
zurück zur Frage |
 |
Das Maß für die Triebkraft einer Reaktion ist die Änderung der freien Enthalpie ΔG.
Sie lässt sich durch die Gibbs-Helmholtz-Gleichung beschreiben.
|
|
ΔG = Änderung der freien Enthalpie ΔH = Reaktionsenthalpie ΔS = Entropieänderung T = Temperatur |
Ist ΔG negativ, nimmt die freie Enthalpie bei der Reaktion ab und die Reaktion kann ohne Energiezufuhr von außen ablaufen.
Das Gleichgewicht einer solchen Reaktion liegt auf der Seite der Produkte, diese Reaktionen heißen exergon.
Ist ΔG positiv, nimmt die freie Enthalpie bei der Reaktion zu und die Reaktion verläuft nicht spontan, sondern nur bei Energiezufuhr.
Das Gleichgewicht der Reaktion  liegt auf der Seite der Edukte (1 mol vs. 0,01 mol).
liegt auf der Seite der Edukte (1 mol vs. 0,01 mol).
1 mol 0,01 mol
Solche Reaktionen nennt man endergon.