Frage 7 - Antwort C
zurück zur Frage |
 |
In der elektrochemischen Spannungsreihe sind Normalpotentiale für Redoxsysteme relativ zur Normalwasserstoffelektrode (willkürlich auf den Wert 0,0 gesetzt) tabelliert.
Je negativer das Normalpotential eines Stoffes ist, desto leichter gibt er Elektronen ab, d.h desto leichter ist er zu oxidieren.
Je positiver das Normalpotential eines Stoffes ist, desto leichter nimmt er Elektronen auf, d.h desto leichter ist er zu reduzieren.
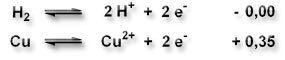
Damit elektrochemische Reaktionen freiwillig ablaufen, muss die elektromotorische Kraft (EMK) positiv sein.
Für Standardbedingungen (1 molare Lösungen, 25°C) gilt:

Es ergibt sich für die Reaktion: 

Die Reaktion läuft also nicht freiwillig ab. Ein Cu-Blech löst sich daher in Salzsäure (HCl) nicht auf.
