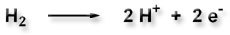Frage 1 - Antwort A
zurück zur Frage |
 |
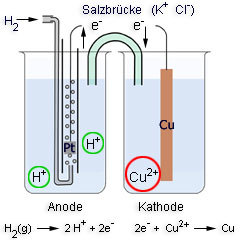 |
Mit einer Wasserstoffelektrode misst man Potentialdifferenzen. Sie besteht aus einer Platinelektrode, die in eine wässrige Lösung vom pH-Wert Null (entspricht einer Wasserstoff-Ionenkonzentration von 1 mol/l) eintaucht und unter Normalbedingungen (25°C, 1 atm) von Wasserstoffgas umspült wird. Es läuft folgender Redoxprozess ab:
Das Potential einer Wasserstoffelektrode kann man nach der Nernstschen Gleichung bestimmen: |
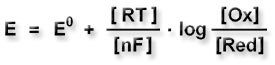 |
R = allgemeine Gaskonstante |
T = absolute Temperatur |
|
n = Zahl der übertragenen Elektronen |
F = Faraday-Konstante |
Das heißt, die Konzentration der H+-Ionen (pH-Wert) steht für die oxidierte Spezies, H2 für die reduzierte Spezies.
Eine Veränderung des Wasserstoffdruckes an der Elektrode würde die Konzentration [Red] und damit auch das Potential der Elektrode verändern.