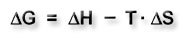Frage 4 - Antwort C
zurück zur Frage |
 |
Hydrophobe Wechselwirkungen zwischen Molekülen erhöhen den Ordnungszustand im Gesamtsystem.
Damit nimmt die Entropie S (als Maß für den "Unordnungszustand") ab.
Dafür wird freie Energie verbraucht (ΔG).
Der Zusammenhang wird durch die Gibbs-Helmholtz-Gleichung beschrieben:
|
|
ΔG = Änderung der freien Enthalpie ΔH = Reaktionsenthalpie ΔS = Entropieänderung T = Temperatur |