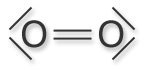Frage 2 - Antwort D
zurück zur Frage |
 |
Sauerstoff hat als Element der 6. Hauptgruppe die Außenelektronenkonfiguration 2s2 2p4.
Zur Erlangung einer Edelgaskonfiguration werden im Sauerstoffmolekül zwei bindende Elektronenpaare benötigt.
Somit verbleiben an jedem Sauerstoffatom zwei freie Elektronenpaare.
Dies wird in der Valenzstrichschreibweise (Lewis-Formel) deutlich.
|
|
|
Sauerstoff-Molekül(für die Bilddarstellung hier klicken) |
Lewis-Formel für das Sauerstoff-Molekül
|
Beachte! Die angegebene Lewis-Formel spiegelt nicht alle Eigenschaften des molekularen Sauerstoffs, z.B. seinen Paramagnetismus, wider.
Eine umfassendere, aber weniger anschauliche Beschreibung der Bindungsverhältnisse ist mit dem Molekülorbital (MO)-Modell möglich.