Frage 4 - Antwort C
zurück zur Frage |
 |
Antwort (1) ist falsch: Isotope haben bei gleicher Zahl von Protonen eine unterschiedliche Anzahl von Neutronen und stehen damit immer an der gleichen Stelle im Periodensystem.
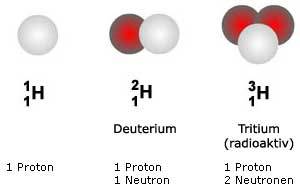
Die Atomkerne der natürlich vorkommenden
|
Beispiel: Wasserstoff Obwohl Protonium, Deuterium und Tritium über unterschiedliche Neutronenzahlen verfügen, handelt es sich chemisch jeweils um Wasserstoff. Kerne mit gleicher Zahl von Nukleonen nennt man Isobare. Sie gehören stets zu unterschiedlichen Elementen. Antwort (2) ist dagegen richtig: Isotope sind Kerne mit gleicher Kernladungszahl (Protonenzahl) und unterschiedlicher Zahl von Neutronen. Von vielen Elementen existieren mehrere stabile Isotope (z.B. 35Cl, 37Cl für Chlor). Das führt in Abhängigkeit vom natürlichen Mischungsverhältnis der Isotope in vielen Fällen zu gebrochenen Zahlen für die Atommassen, z.B. 35,45 für Chlor (Isotopenzusammensetzung: 35Cl: ca. 75%; 35Cl: ca. 25%). |
